«Суноси»: новое лекарство от чрезмерной дневной сонливости

«Суноси» (Sunosi, солриамфетол) — новое лекарственное средство, предназначенное для улучшения статуса бодрствования у взрослых пациентов, страдающих чрезмерной сонливостью в дневное время, вызванной нарколепсией или синдромом обструктивного апноэ сна. «Суноси» разработан «Джаз Фармасьютикалс» (Jazz Pharmaceuticals).
Соответствующее разрешение выдано Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). При этом «Суноси» не показан для лечения синдрома обструктивного апноэ сна. Перед назначением «Суноси» следует провести терапию последнего при помощи непрерывного положительного давления в дыхательных путях (CPAP).
Европейское агентство по лекарственным средствам (EMA) также разрешило «Суноси»: препарат предназначен для улучшения статуса бодрствования и уменьшения чрезмерной сонливости в дневное время у взрослых пациентов с нарколепсией (с катаплексией или без нее) или синдромом обструктивного апноэ сна (если сонливость успешно не купируется его первичной терапией, такой как CPAP).
«Суноси»: механизм действия солриамфетола
Точный механизм действия, благодаря которому пероральный солриамфетол (solriamfetol, JZP-110) способствует бодрствованию у пациентов с чрезмерной сонливостью в дневное время по причине нарколепсии или синдрома обструктивного апноэ сна, не установлен. Считается, что терапевтическая эффективность солриамфетола опосредована двойным ингибированием обратного захвата дофамина и норадреналина (DNRI): молекула усиливает сигнализацию этих нейротрансмиттеров в системе возбуждения ствола головного мозга.
Солриамфетол связывается с переносчиками дофамина и норадреналина (Ki 14,2 и 3,7 мкмоль) и подавляет обратный захват этих нейромедиаторов (IC50 2,9 и 4,4 мкмоль). Солриамфетол не обладает заметным связывающим сродством к переносчику серотонина (Ki 81,5 мкмоль) и не ингибирует обратный захват последнего (IC50 > 100 мкмоль). Солриамфетол не располагает выраженной аффинностью к рецепторам дофамина, серотонина, норадреналина, ГАМК, аденозина, гистамина, орексина, бензодиазепина, а также ацетилхолиновым мускариновым или ацетилхолиновым никотиновым рецепторам.
 См. видео
См. видео
Предполагаемое двойное ингибирование обратного захвата дофамина и норадреналина, обеспечиваемое солриамфетолом, является сходным с оказываемым амфетамином или декстроамфетамином — с точки зрения нейроповеденческих эффектов. Однако есть ряд механистических различий. Так, солриамфетол не воздействует на рецептор 1 следовых аминов (TAAR1) или везикулярные моноаминные переносчики 1 и 2 (VMAT1 и VMAT2). Это объясняет, почему солриамфетол не запускает процесс высвобождения дофамина и норадреналина в синаптическую щель так, как это делают амфетамины. Опять же, существует ряд препаратов, например бупропион, которые, относясь к классу DNRI, не считаются амфетаминами. Другими словами, солриамфетол по своему психостимулирующему эффекту похож на амфетамины и модафинил, но его нельзя к относить к амфетаминовому ряду.
«Суноси»: терапевтическая эффективность солриамфетола
Клиническая программа TONES, включившая четыре клинических испытания фазы III (рандомизированных, двойных слепых, плацебо-контролируемых, с параллельными группами, многоцентровых, международных), изучила эффективность солриамфетола на более чем 900 взрослых пациентов, страдающих повышенной дневной сонливостью.
Результативность лечения оценивалась двумя первичными конечными точками: тестом на поддержание бодрствования (MWT) и изменением балла по Эпвортской шкале сонливости (ESS). Первый измеряет способность человека не спать в дневное время в темной, тихой обстановке: пациентов инструктируют не спать как можно дольше в ходе четырех-пяти 40-минутных сеансов тестирования, проводимых в течение дня с интервалом в 2 часа между ними, — задержка сна определяется средним количеством минут бодрствования в течение первых четырех сеансов тестирования. Вторая представлена анкетой из 8 вопросов, отвечая на которые пациенты оценивают предполагаемую вероятность засыпания во время привычной повседневной деятельности.
Среди вторичных конечных точек: оценка пациентом общего впечатления об изменении собственного состояния (PGI-C), реализованная 7-балльной шкалой, по которой испытуемый оценивал тяжесть симптомов заболевания.
Так, клиническое исследование NCT02348593 проверило солриамфетол среди пациентов (n=231) с нарколепсией. Участникам, в 51% случаев заболевание которых сопровождалось катаплексией, назначали 1 раз в день плацебо либо солриамфетол в дозе 75, 150 или 300 мг.
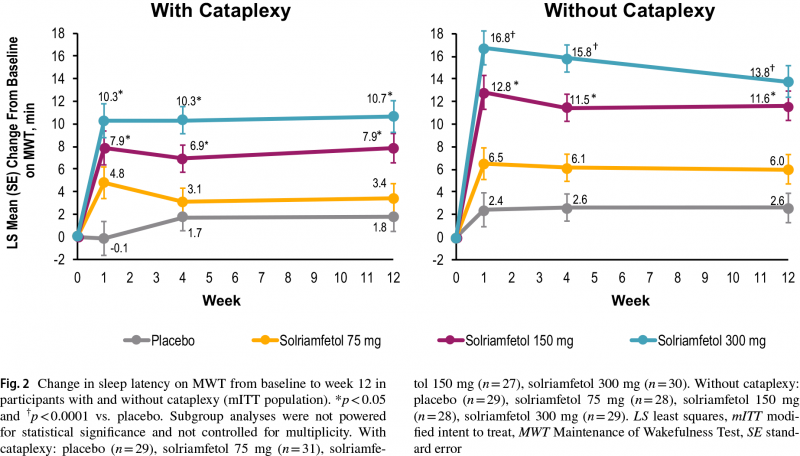
По истечении 12 недель пациенты с катаплексией, получавшие солриамфетол в вышеуказанных дозах, продемонстрировали среднеквадратичное среднее изменение (здесь и далее) задержки сна в тесте MWT на уровне 3,4 минуты (95% ДИ: −0,4 — 7,2), 7,9 (4,1–11,7) и 10,7 (6,8–14,5) — против 1,8 минуты (−1,9 — 5,4) в группе плацебо (p<0,05 для 150- и 300-мг дозы солриамфетола).
Пациенты без катаплексии показали изменение на 6,0 (2,2–9,8), 11,6 (7,9–15,4) и 13,8 (9,8–17,8) минуты — против 2,6 минуты (−1,1 — 6,2) в контрольной группе (p<0,05 для 150-мг дозы солриамфетола, p<0,0001 для 300-мг).
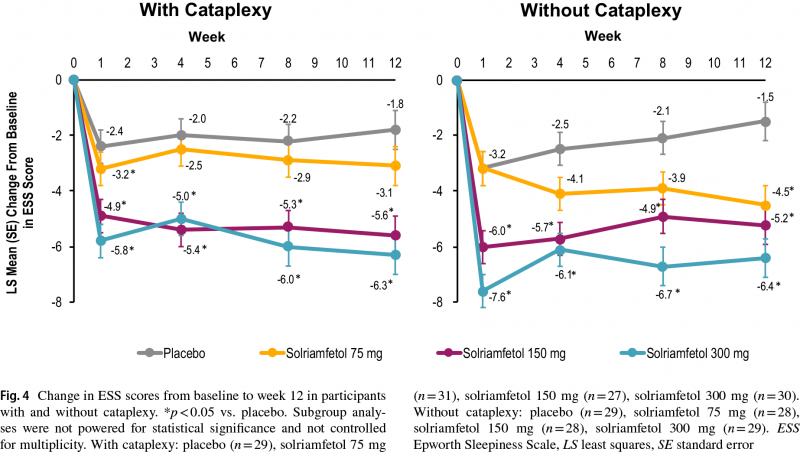
В подгруппе пациентов с катаплексией, которым назначали солриамфетол, изменение балла ESS составило −3,1 (−5,0 — −1,2), −5,6 (−7,5 — −3,7) и −6,3 (−8,2 — −4,5) — в сравнении с изменением на −1,8 (−3.7 — −0.02) в группе плацебо (p<0,05 для 150- и 300-мг дозы препарата).
Среди пациентов без катаплексии изменение балла ESS получилось равным −4,5 (−6,4 — −2,6), −5,2 (−7,1 — −3,4) и −6,4 (−8,4 — −4,4) — против −1,5 (−3,3 — 0,3) в группе контроля (p<0,05 для всех доз солриамфетола).
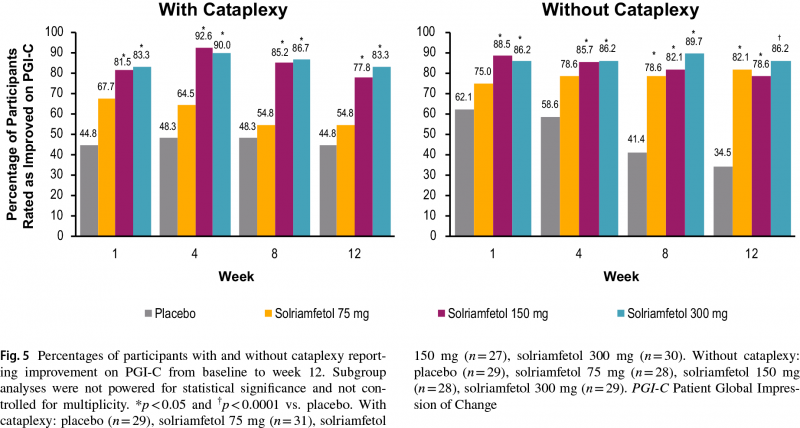
Что касается улучшения показателя PGI-C, усредненная процентная разница с плацебо составила 10% (−15 — 35), 33% (9–57) и 39% (16–61) — в подгруппе пациентов с катаплексией (p<0,05 для 150- и 300-мг доз солриамфетола), 48% (25–70), 44% (21–67) и 52% (30–73) — в подгруппе без катаплексии (p<0,001 для всех доз).
Клиническое исследование NCT02348606, протестировавшее солриамфетол среди пациентов (n=459) с обструктивным сонным апноэ, сходным образом установило терапевтическую эффективность «Суноси», статистически значимо превосходящую таковую у плацебо.
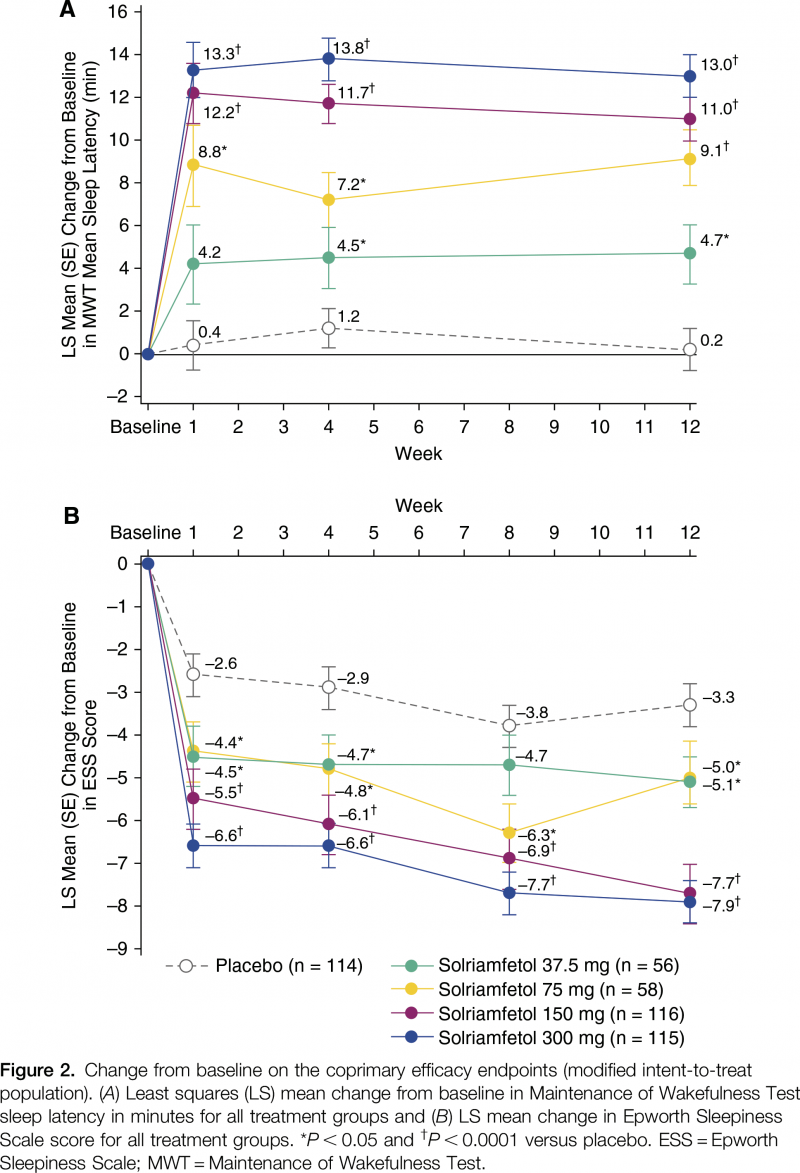
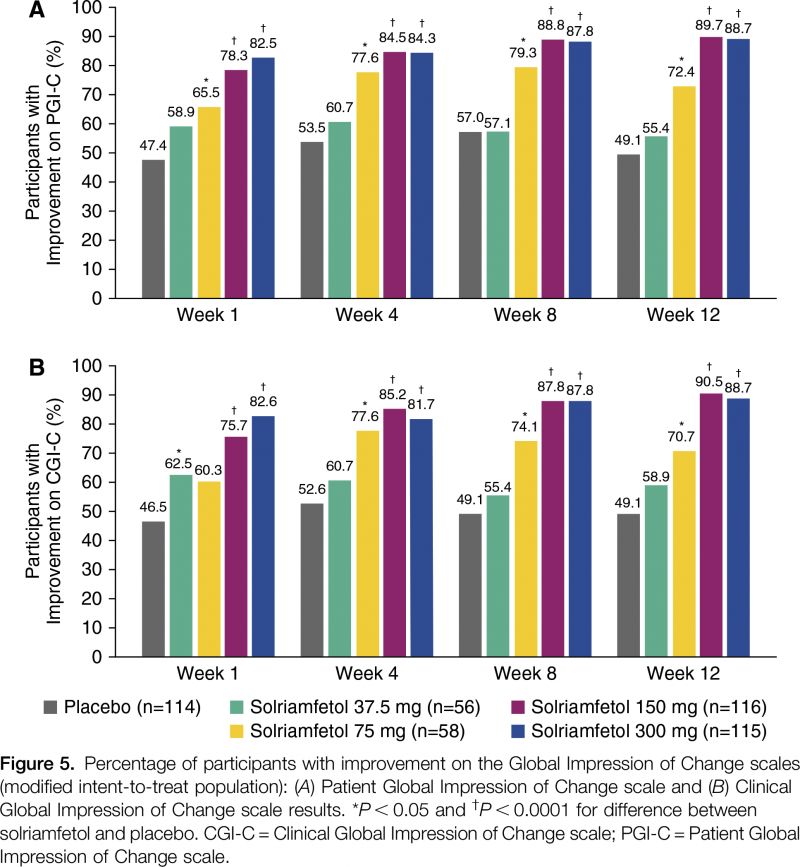
Сравнительная результативность применения солриамфетола у пациентов с нарколепсией или синдромом обструктивного апноэ сна, отмеченная в клинических испытаниях NCT02348593 и NCT02348606, приведена ниже:
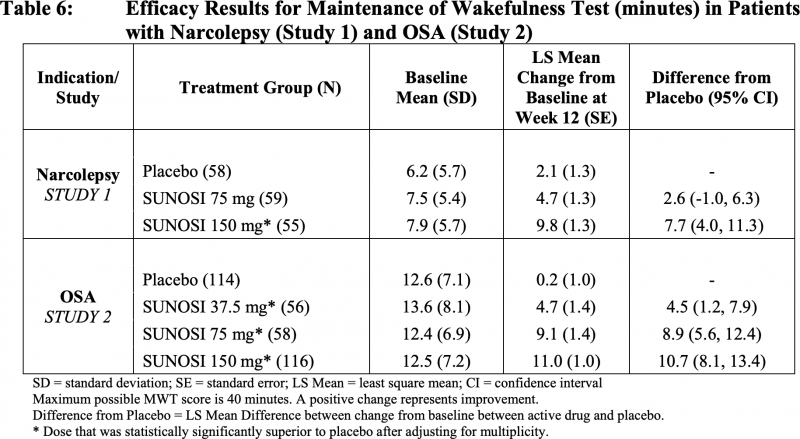
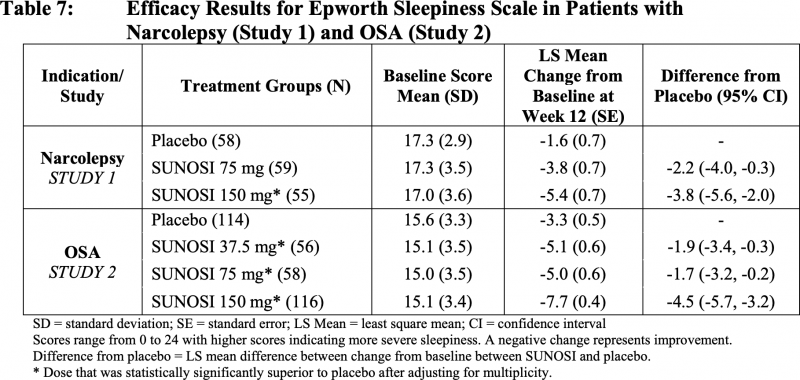
«Суноси»: безопасность солриамфетола
Побочные реакции, связанные с применением «Суноси», типичные для других лекарственных средств с общими фармакодинамическими свойствами (стимуляторы, бупропион): обратимая анорексия, беспокойство и нервозность, бессонница и раздражительность, сухость во рту, тошнота, диарея. Впрочем, никакие из указанных негативных явлений вреда нанести не способны.
Основная претензия к солриамфетолу с точки зрения его безопасности сводится к увеличению артериального давления, притом что его рост может оставаться незамеченным. И потому в инструкции по медицинскому применению «Суноси» дано указание равно как отслеживать изменения артериального давления и частоты пульса в ходе терапии солриамфетолом, так и не назначать препарат пациентам с нестабильным сердечно-сосудистым заболеванием, серьезной сердечной аритмией и прочими тяжелыми кардиологическими нарушениями.
«Суноси»: коммерческое будущее солриамфетола
Рыночный запуск «Суноси» стал для «Джаз» двойственным с точки зрения предполагаемого коммерческого успеха. С одной стороны, наивысшая 300-мг доза препарата не была одобрена: несмотря на усиленную терапевтическую эффективность, регулятор сослался на побочные реакции. С другой же, инструкция по медицинскому применению «Суноси» оказалась избавленной от «чернорамочного» предупреждения.
Кроме того, солриамфетол, получив подкрепление клиническими данными лечения чрезмерной дневной сонливости из-за синдрома обструктивного апноэ сна, пригоден для существенно более широкой популяции пациентов, нежели как если он был бы разрешен лишь при нарколепсии.
Согласно прогнозам отраслевых экспертов, к 2024 году спрос на «Суноси» достигнет без малого полумиллиарда долларов.
В январе 2019 года «Джаз» сумела заблокировать генерическую конкуренцию, которую лекарства-копии хотели составить ее бестселлеру «Зайрем» (Xyrem, оксибутират натрия), в 2018 и 2019 гг. заработавшему 1,40 и 1,64 млрд долларов соответственно. Дженерики «Зайрема», одобренного FDA в июле 2002 года для терапии катаплексии или чрезмерной сонливости в дневное время, вызванных нарколепсей у пациентов 7 лет и старше, увидят свет не ранее 2023 года.
Дополнительные материалы
Инструкция по медицинскому применению лекарственного препарата «Суноси» (Sunosi, солриамфетол) в США. [PDF]
Инструкция по медицинскому применению лекарственного препарата «Суноси» (Sunosi, солриамфетол) в Европе. [PDF]
Sunosi. EMA European Public Assessment Report (EPAR). [PDF]
Sunosi. FDA Joint Supervisory Review (JSR). [PDF]
Solriamfetol for the Treatment of Excessive Daytime Sleepiness in Participants with Narcolepsy with and without Cataplexy: Subgroup Analysis of Efficacy and Safety Data by Cataplexy Status in a Randomized Controlled Trial. CNS Drugs. 2020 Jul;34(7):773-784. [PDF] [источник]
Solriamfetol for Excessive Sleepiness in Obstructive Sleep Apnea (TONES 3). A Randomized Controlled Trial. Am J Respir Crit Care Med. 2019 Jun 1; 199(11): 1421–1431. [PDF] [источник]
Measures of functional outcomes, work productivity, and quality of life from a randomized, phase 3 study of solriamfetol in participants with narcolepsy. Sleep Med. 2020 Mar;67:128-136. [PDF] [источник]
Effects of Solriamfetol on Quality-of-Life Measures from a 12-Week Phase 3 Randomized Controlled Trial. Ann Am Thorac Soc. 2020 Aug;17(8):998-1007. [PDF] [источник]
Clinically relevant effects of solriamfetol on excessive daytime sleepiness: a post hoc analysis of the magnitude of change in clinical trials in adults with narcolepsy or obstructive sleep apnea. J Clin Sleep Med. 2020 Nov 23. [источник]
Источник: Мосмедпрепараты
Комментарии - 1