Витамин D и метаболизм: факты, мифы и предубеждения

Витамин D необходим для широкого спектра физиологических процессов и оптимального состояния здоровья. В детстве и юности адекватные уровни витамина D нужны для обеспечения роста клеток, формирования скелета и роста. Витамин D является жирорастворимым витамином, который содержится в очень немногих продуктах питания. Основным источником его являются обогащенные продукты и биологически активные добавки к пище. Витамин D вырабатывается в организме, когда ультрафиолетовое излучение попадает на кожу. Адекватное потребление и статус витамина D во многом зависят от возраста, сопутствующих заболеваний и использования некоторых лекарственных препаратов и подробно освещены в данной статье. Последние эпидемиологические и экспериментальные данные показали, что низкий уровень витамина D тесно связан с уровнем общей смертности, сердечно-сосудистыми и онкологическими заболеваниями (в основном молочной железы, простаты и толстого кишечника), артериальной гипертензией, метаболическим синдромом, сахарным диабетом 1 и 2 типов. Тем не менее, данные, подтверждающие защитный эффект витамина D помимо заболеваний костной ткани, таких как рахит, остеопороз и остеомаляция, не обладают высокой достоверностью, поэтому только проводимые в настоящее время крупные контролируемые клинические испытания позволят дать ответы на эти вопросы.
Витамин D является жирорастворимым витамином, который естественным образом присутствует лишь в очень ограниченном количестве продуктов питания. В организме человека он вырабатывается только в определенных условиях, когда ультрафиолетовые лучи солнечного света попадают на кожу. Витамин D, образующийся при пребывании на солнце, из продуктов питания и в виде добавок к пище биологически инертен и для активации в организме должен пройти два процесса гидроксилирования. Первый происходит в печени и превращает витамин D в 25-гидроксивитамин D [25(OH)D], также известный как кальцидиол. Второе гидроксилирование происходит преимущественно в почках, и его результатом является синтез физиологически активного 1,25-дигидроксивитамина D [1,25(OH)2D], или кальцитриола [1].
Витамин D способствует абсорбции кальция в кишечнике и поддерживает необходимые уровни кальция и фосфатов в крови для обеспечения минерализации костной ткани и предотвращения гипокальциемической тетании. Он также необходим для роста костей и процесса костного ремоделирования, т.е. работы остеобластов и остеокластов [1, 2]. Без достаточного количества витамина D кости могут стать тонкими и легко ломаться. Достаточный уровень витамина D предотвращает развитие рахита у детей и остеомаляции у взрослых [1]. Вместе с кальцием витамин D также применяется для профилактики и в составе комплексного лечения остеопороза.
Функции витамина D не ограничены только контролем кальций-фосфорного обмена, он также влияет и на другие физиологические процессы в организме, включающие модуляцию клеточного роста, нервно-мышечную проводимость, иммунитет и воспаление [1, 3, 4]. Экспрессия многих генов, кодирующих белки, участвующие в пролиферации, дифференцировке и апоптозе, регулируется витамином D. Многие клетки имеют рецепторы к витамину D, а некоторые клетки даже могут преобразовывать 25(OH)D в 1,25(OH)2D [1].
Сывороточная концентрация 25(OH)D является лучшим показателем статуса витамина D, поскольку отражает суммарное количество витамина D, производимого в коже и получаемого из пищевых продуктов и пищевых добавок (витамин D в виде монопрепарата или мультивитаминных и витаминно-минеральных комплексов), и имеет довольно продолжительный период полураспада в крови – порядка 15 дней [1, 5]. Хотя нужно принимать во внимание, что уровни 25(OH)D в сыворотке крови напрямую не отражают запасы витамина D в тканях организма. В отличие от 25(OH)D, активная форма витамина D (1,25(OH)2D), как правило, не является индикатором запасов витамина D, поскольку имеет короткий период полураспада (менее 15 часов) и жестко регулируется уровнями паратгормона, кальция и фосфатов [5]. Концентрация 1,25(OH)2D в сыворотке крови обычно не снижается до тех пор, пока дефицит витамина D не достигнет критических значений [2, 6].
Очень много споров вызывают оптимальные уровни 25(OH)D в сыворотке крови для обеспечения здоровья костей и оптимального общего состояния здоровья. В настоящее время считается, что лица подвергаются риску дефицита витамина D при концентрации 25(OH)D в сыворотке крови <30 нмоль/л (<12 нг/мл). Уровни 25(OH)D 30–50 нмоль/л (12–20 нг/мл) расцениваются как недостаточность витамина D, при которой проявления дефицита витамина наблюдаются у меньшего числа пациентов. Достаточность витамина D определена на уровне ≥50 нмоль/л (≥20 нг/мл). Считается, что уровень 25(OH)D более 50 нмоль/л покрывает потребность в витамине D 97,5% населения. Концентрация 25(OH)D >125 нмоль/л (>50 нг/мл) может быть связана с потенциально неблагоприятными эффектами [1] (табл. 1).

Дополнительные сложности в оценке статуса витамина D представляет точность измерения концентрации 25(OH)D с помощью различных коммерческих наборов. Значительная вариабельность существует между различными методами (двумя наиболее распространенными методами являются иммуноферментный анализ и жидкостная хроматографиия) и между лабораториями, которые проводят анализ [1, 7, 8]. Это означает, что по сравнению с фактической концентрацией 25(OH)D в образце сыворотки крови, могут быть получены в зависимости от используемого метода анализа и лаборатории ложно низкие или ложно высокие значения [9]. Стандартный лабораторный контроль для 25(OH)D стал доступен в июле 2009 г. Его использование позволяет стандартизировать получаемые результаты [1, 10].
Потребность в витамине D
Потребность в витамине D варьирует в зависимости от возраста и пола и может быть представлена различными переменными, которые включают:- рекомендуемая дневная норма потребления (RDA): средний ежедневный уровень потребления, достаточный для удовлетворения потребности в питательных веществах почти всех (97%–98%) здоровых людей;
- уровень адекватного потребления (AI): устанавливается, когда доказательств недостаточно, чтобы разработать RDA, на уровне, который специалистами предполагается адекватным для обеспечения потребности;
- максимально допустимый уровень потребления (UL): максимальная суточная доза, которая с большей вероятностью не вызывает неблагоприятные последствия для здоровья [1].
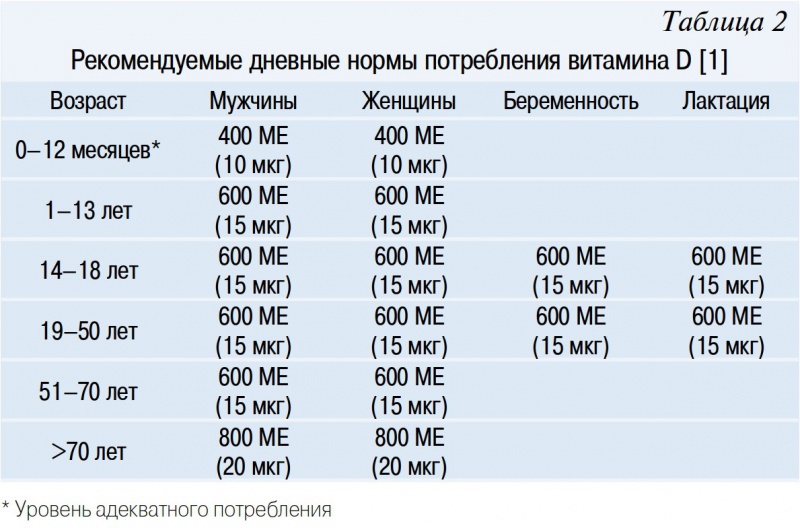
Несмотря на то, что солнечный свет может быть одним из основных источников витамина D для некоторых людей, уровни адекватного потребления витамина D устанавливаются на основе минимального пребывания на солнце [1].
Источники витамина D
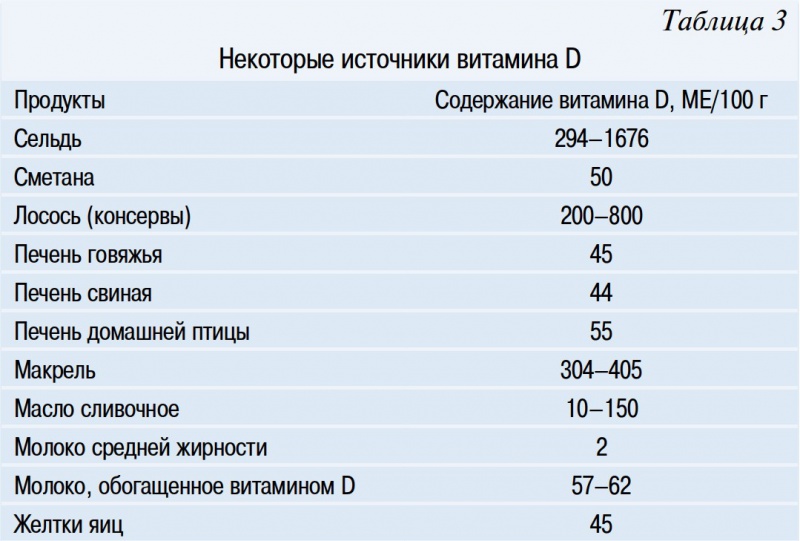
Пищевые продуктыОчень немногие продукты в природе содержат витамин D. Мясо жирной рыбы (такой, как лосось, тунец, макрель) и масло печени рыб являются одними из лучших его источников [1, 11]. Небольшое количество витамина D можно найти в говяжьей печени, сыре и яичном желтке. Витамин D в этих продуктах в основном находится в виде витамина D3 и его метаболита 25(OH)D3 [12]. Некоторые грибы могут быть источником витамина D2, но его содержание в них, как правило, очень вариабельно [13, 14].
Обогащенные продукты питания могут обеспечивать большую часть витамина D в диете [1, 14]. Например, с этой целью почти все молоко в США обогащено витамином D из расчета 100 МЕ/200 мл [1]. В Канаде молоко обогащается в соответствии с законодательством страны 35–40 МЕ/100 мл, так же как и маргарин ≥530 МЕ/100 г. Программа обогащения молока витамином D в США стартовала в 1930 г. для борьбы с рахитом, являвшимся на тот момент основной проблемой мирового здравоохранения [1].
В России нет официальной программы по обогащению продуктов витамином D, кроме тех, которые используются для детского питания. В то же время производители некоторых марок пищевых продуктов активно обогащают их различными витаминноминеральными добавками, в т.ч. и витамином D (молоко и кисломолочные продукты, хлебобулочные изделия, готовые зерновые завтраки и др.).
Пребывание на солнце
Большинство людей получают, по крайней мере, некоторое количество необходимого им витамина D под воздействием солнечного света [1, 2]. Ультрафиолетовое (УФ) бета-излучение с длиной волны 290–320 нм проникает в кожу и преобразует 7-дегидрохолестерин в провитамин D3, который, в свою очередь, превращается в витамин D3 [1].
Синтезированный в коже под воздействием солнечного света в течение весны, лета и осенних месяцев витамин D может храниться в печени и жировой ткани и обеспечивать достаточные уровни в крови в течение зимы даже в далеких северных широтах [1].
Сезон, время суток, продолжительность светового дня, облачность, наличие смога, содержание меланина в коже и применение солнцезащитных кремов являются одними из факторов, влияющих на количество УФ-облучения и синтез витамина D [1]. Может показаться удивительным, но географическая широта проживания не всегда может предсказать средний сывороточный уровень 25(OH)D у населения. Например, в странах Ближнего и Дальнего Востока уровни витамина D могут соответствовать таковым у жителей северных широт, что связывают с особенностями национальной одежды и питания.
Полная облачность уменьшает УФ-энергию на 50%, тень – на 60% [16]. УФ-излучение не проникает сквозь стекло, поэтому воздействие солнечного света в помещении через окно не приводит к синтезу витамина D [17]. Солнцезащитные крема с фактором солнечной защиты (SPF) 8 и более блокируют УФ-лучи, длина волны которых активирует синтез витамина. Хотя на практике люди не применяют их в достаточном количестве, так как наносят не на все открытые для солнца участки кожи или не обновляют нанесение солнцезащитного крема [1, 18]. Поэтому, вполне вероятно, что кожа синтезирует некоторое количество витамина D даже при применении солнцезащитного крема.
Большое количество факторов, влияющих на УФ-облучение, не позволяет разработать какие-либо рекомендации по пребыванию на солнце, необходимому для поддержания адекватного уровня витамина D. Пребывание на солнце также ограничивается неблагоприятным влиянием солнечного излучения на возникновение некоторых видов рака. Было высказано предположение, что 5–30 минут пребывания на солнце между 10 утра и 3 вечера, по крайней мере, два раза в неделю с оголенными лицом, руками, ногами или спиной без солнцезащитного крема приводит к синтезу достаточного количества витамина D и что умеренное посещение соляриев, которые испускают 2–6% УФ бета-волн также является эффективным [6, 19]. Лицам же с ограниченным пребыванием на солнце необходимо включать в свой рацион источники витамина D или принимать добавки для достижения рекомендуемого уровня потребления витамина.
Несмотря на неоспоримую важность солнечного света для синтеза витамина D, современная медицина рекомендует ограничить его воздействие на кожу [18], также не рекомендуется использование соляриев [20]. УФ-излучение является канцерогеном, ответственным за большинство видов рака кожи и смерти от метастатической меланомы [18]. Совокупный ущерб УФ-излучения в течение жизни на клетки кожи, в значительной степени, ответствен за связанные с возрастом сухость и другие косметические изменения. Различные дерматологические ассоциации рекомендуют активную фотопротекцию, включая использование солнцезащитного крема всякий раз, когда человек подвергается воздействию солнца [21]. Исследований, посвященных безопасности для кожи УФ-индуцированного синтеза витамина D, до настоящего времени не проводилось [1].
Биологически активные добавки к пище
Как правило, в продукты питания витамин D добавляется в виде одной из двух форм: D2 (эргокальциферол) или D3 (колекальциферол), которые различаются между собой только строением боковой цепи. Витамин D2 изготовляется путем УФ-облучения эргостерина у дрожжей, а витамин D3 производится при облучении 7-дегидрохолестерина, полученного из ланолина, с дальнейшим химическим превращением в холестерин [6]. Эти две формы традиционно считаются эквивалентными по своей эффективности для профилактики и лечения рахита и, действительно, большинство метаболических путей у витамина D2 и витамина D3 одинаковы. Обе формы, а также витамин D в продуктах питания и синтезируемый в коже, эффективно повышают сывороточные уровни 25(OH)D [2], и четких отличий в их действии не существует. Но все же, несмотря на то, что в питании дозы витаминов D2 и D3 эквивалентны, при необходимости применения высоких доз витамин D2 представляется менее эффективным [1].
Всемирная организация здравоохранения, а также педиатрические организации различных стран мира рекомендуют детям на полном и частичном грудном вскармливании добавлять в питание по 400 МЕ/сут (10 мкг) витамина D с 1–1,5 месяцев после рождения до достижения детьми возраста 3 лет или до момента отнятия их от груди, при условии, что дети будут получать ≥1000 мл в сутки обогащенных витамином D продуктов питания (молочные продукты, заменители грудного молока) [22]. Также рекомендуется, что дети старшего возраста и подростки, которые не получают 400 МЕ/сут с витаминизированным молоком и другими продуктами, должны дополнительно получать 400 МЕ витамина D ежедневно в виде биологически активных добавок. Тем не менее, последние рекомендации, изданные Эндокринологическим обществом (Endocrine Society) в июне 2011 г., указывают на необходимость приема более высоких доз витамина D (600 МЕ/сут) среди лиц от 1 до 70 лет [23].
Потребление витамина D с пищей и его уровни в крови
Американское исследование NHANES (National Health and Nutrition Examination Survey – Анкетное исследование национального здоровья и питания, проводившееся в 2005–2006 гг.), в том числе, оценивало потребление витамина D с пищей и в виде пищевых добавок [4]. Средний уровень потребления витамина только с пищевыми продуктами для мужчин колебался от 204 до 288 МЕ/сут, для женщин – от 144 до 276 МЕ/сут, в зависимости от возраста. При учете биологически активных добавок, содержащих витамин D, которые принимали около 37% опрошенного населения США и, наиболее часто, пожилые женщины, средние уровни потребления оказались существенно выше. Так, среднее потребление витамина D только из пищи для женщин в возрасте 51–70 лет составило 156 МЕ/сут, а с добавками – 404 МЕ/сут. Для женщин старше 70 лет соответствующие показатели составили 180 МЕ/сут и 400 МЕ/сут [1].Оценка прямого влияния витамина D, получаемого из пищи или с приемом витаминных добавок, на концентрацию 25(OH)D весьма проблематична. Одной из причин этого является то, что сравнение может быть проведено только на основании средних значений в группах, а не у отдельно взятых людей. Другой причиной является влияние инсоляции, и сывороточные уровни 25(OH)D крови, как правило, выше, чем можно было бы предполагать по количеству потребления витамина D [1]. Исследование NHANES показало, что средние уровни 25(OH)D среди населения США превышают 56 нмоль/л (22,4 нг/мл). Самые высокие уровни (71,4 нмоль/л, или 28,6 нг/мл) зафиксированы у девочек в возрасте 1–3 лет, а самые низкие (56,5 нмоль/л, или 22,6 нг/мл) у женщин в возрасте 71 года и старше. Как правило, у молодых людей уровни 25(OH)D были выше, чем у пожилых, а у мужчин выше, чем у женщин. Уровни 25(OH)D порядка 50 нмоль/л (20 нг/мл) согласуются с потреблением витамина D из пищи и пищевых добавок, эквивалентных RDA [1].
За последние 20 лет средняя концентрация 25(OH)D в Соединенных Штатах немного снизилась среди мужчин, но не женщин. Это снижение, скорее всего, связано с одновременным увеличением массы тела, недостаточным потреблением молока и более широким использованием солнцезащитных кремов [24].
Дефицит витамина D
Недостаток питательных веществ, как правило, является результатом неадекватного питания, нарушенного всасывания, повышенной потребности, невозможности правильного использования витамина D или повышения его экскреции. Дефицит витамина D может возникнуть при потреблении в течение долгого времени витамина D ниже рекомендованного уровня, когда воздействие солнечного света на кожу ограничено или почки не могут конвертировать 25(OH)D в его активную форму, а также при недостаточном всасывании витамина D из желудочно-кишечного тракта. Питание, обедненное витамином D, как правило, связано с аллергией на молочный белок, непереносимостью лактозы, ово-вегетарианством и строгим вегетарианством [1].Рахит и остеомаляция – классические проявления дефицита витамина D. У детей дефицит витамина D вызывает рахит – болезнь, характеризующуюся недостаточной минерализацией костной ткани, в результате чего формируются мягкие кости и деформации скелета [16]. Рахит был впервые описан в середине 17-го века британскими исследователями [16, 25]. В конце 19 и начале 20 века немецкие врачи отметили, что ежедневное употребление 1–3 чайных ложек рыбьего жира может предотвратить развитие этого заболевания [25].
Длительное грудное вскармливание является серьезной причиной рахита у детей, поскольку грудное молоко содержит очень мало витамина D, особенно когда уровни витамина D у матери также не являются оптимальными [26]. Другие причины рахита включают широкое использование солнцезащитных кремов и посещение детьми детских дошкольных учреждений, где дети проводят меньше времени на солнце [16, 25]. Рахит также больше распространен среди выходцев из Азии, Африки и Ближнего Востока, возможно, из-за генетических различий в метаболизме витамина D или культурных особенностей, которые уменьшают воздействие солнечных лучей на кожу.
У взрослых дефицит витамина D может приводить к остеомаляции [1, 5]. Наличие болей в костях и мышечной слабости может указывать на недостаточность уровней витамина D, но такие симптомы могут быть неяркими и часто остаются незамеченными в начальной стадии заболевания.
Группы риска недостаточности витамина D
Получение достаточного количества витамина D из натуральных пищевых источников довольноза труднительно. Для многих людей потребление продуктов питания, обогащенных витамином D, и пребывание на солнце имеют важное значение для поддержания адекватных уровней витамина D. В некоторых группах необходимо применение пищевых добавок для удовлетворения суточной потребности в витамине D.
Грудные младенцы
Потребность в витамине D не может быть восполнена только грудным молоком [1, 27], которое обеспечивает от <25 МЕ/л до 78 МЕ/л витамина. Содержание витамина D в грудном молоке женщин напрямую связано с концентрацией витамина D у матери [22]. В исследовании заболеваемости рахитом, проведенном канадскими педиатрами, было установлено, что распространенность рахита составляет 2,9 на 100 000, и практически все заболевшие дети были на грудном вскармливании [29]. В то время как солнце является потенциальным источником витамина D, педиатрические ассоциации рекомендуют охранение детей от прямых солнечных лучей, ношение защитной одежды и применение солнцезащитных кремов [30].
Пожилые люди
Пожилые люди подвергаются повышенному риску развития недостаточности витамина D, в частности из-за того, что с возрастом кожа не может эффективно синтезировать витамин D, пожилые люди могут проводить больше времени в помещении и недостаточно получать витамин с питанием [1]. Почти половина пожилых людей с переломами бедра может иметь сывороточные уровни 25(OH)D <30 нмоль/л (<12 нг/мл) [2].
Люди с ограниченным пребыванием на солнце
Люди, проводящие практически все дневное время в закрытых помещениях, женщины, которые носят длинные одежды и головные уборы по религиозным соображениям, как правило, не получают адекватные количества витамина D от солнечного света [31, 32]. В связи с тем, что масштабы и частота использования солнцезащитного крема неизвестны, значение его роли в снижении синтеза витамина D не ясно [1].
Люди с темной кожей
Увеличение содержания в эпидермальном слое коже пигмента меланина приводит к более темному окрашиванию кожных покровов и уменьшает способность кожи вырабатывать витамин D от солнечного света [1]. Различные исследования неизменно показывают более низкий сывороточный уровень 25(OH)D у лиц с темной кожей по сравнению с теми, кто относит себя к белой расе. Пока не ясно, могут ли сниженные уровни 25(OH)D для людей с темной кожей иметь какие-либо значимые последствия для здоровья. Например, в исследованиях, проведенных в США, было показано, что частота переломов и остеопороза ниже среди афроамериканцев по сравнению с лицами белой расы.
Люди с нарушением всасывания жиров
Витамин D, как жирорастворимый витамин, требует присутствия в кишечнике некоторых пищевых жиров для обеспечения его адекватного всасывания. Лица, которые страдают нарушениями переваривания и всасывания жиров, могут также получать недостаточные количества витамина D, равно как и других жирорастворимых витаминов [33]. Нарушенное всасывание жиров связано с целым рядом заболеваний, включая некоторые формы заболеваний печени, муковисцидоз, болезнь Крона [3].
Люди, страдающие ожирением или подвергшиеся операции шунтирования желудка
Индекс массы тела ≥30 связан со снижением сывороточных уровней 25(OH)D по сравнению с лицами, не страдающими ожирением. Возможно, людям, которые страдают ожирением, требуется большее потребление витамина D для достижения целевых уровней 25(OH)D, чем людям с нормальным весом [1]. Ожирение не влияет на способность кожи синтезировать витамин D, но избыточное количество подкожного жира может поглощать больше витамина D и изменять его доступность для кровообращения. У больных ожирением после операции шунтирования желудка может развиваться дефицит витамина D без достаточного потребления этого питательного вещества из пищи или в виде добавок, так как часть тонкой кишки, которая отвечает за всасывание витамина D, исключается из пищеварения. При этом витамин D, мобилизирующийся в центральный кровоток из жировых депо, не может поддерживать его уровни в крови в течение длительного времени [34, 35].
Витамин D и здоровье
Необходимые концентрации 25(OH)D в крови для оптимального состояния костной системы и общего состояния здоровья в настоящее время не установлены. И, скорее всего, для каждого этапа жизни они свои и различаются в зависимости от выбранного физиологического параметра [1, 2, 6]. Кроме того, как было сказано ранее, сывороточные уровни 25(OH)D расцениваются как биомаркер получения организмом витамина D из различных источников (от солнца, продуктов питания и пищевых добавок), но четко не установлено, в какой степени эти уровни могут служить также биомаркером его действия [1].Известно, что уровни 25(OH)D в сыворотке крови повышаются при его активном потреблении с едой или витаминными добавками, но зависимость не является линейной, что пока не нашло объяснения [1]. Степень повышения зависит от исходных уровней витамина D и длительности дополнительного приема. Для увеличения сывороточного уровня 25(OH)D до >50 нмоль/л требуется больше витамина D, чем для повышения его от исходного уровня до <50 нмоль/л. Уровни 25(OH)D крови увеличиваются более значимо, когда доза витамина D составляет <1000 МЕ/сут, и менее интенсивно при более высоких суточных дозах. При дозе ≥1000 МЕ/сут повышение сывороточного уровня 25(OH)D составляет около 1 нмоль/л для каждого 40 МЕ потребления. В исследованиях с дозой ≤600 МЕ/сут рост сывороточного уровня 25(OH)D составил примерно 2,3 нмоль/л на каждые 40 МЕ витамина D [1].
В марте 2007 г. группа исследователей витамина D опубликовала спорные и провокационные данные, утверждая, что целевая концентрация 25(OH) D должна составлять ≥75 нмоль/л (≥30 нг/мл) [36]. Они также отметили, что порядка 1700 МЕ/сут витамина D необходимо для повышения сывороточного уровня 25(OH)D с 50 до 80 нмоль/л (20–32 нг/мл).
В ответ на эту публикацию, специалисты комитета Пищевых продуктов и питания США (Food and Nutrition Board; FNB), которые устанавливают рекомендуемые национальные нормы потребления пищевых продуктов, рассмотрели длинный список потенциальных эффектов витамина D на здоровье, на которых основаны рекомендации по приему витамина D в указанных высоких дозах [1]. К ним относились профилактика хронических заболеваний (таких, как рак и сердечно-сосудистые заболевания), физиологические параметры (такие, как иммунный ответ или уровни паратгормона) и функциональные характеристики (например, здоровье костей, физическая работоспособность и падения). При проверке, за исключением здоровья костей, влияние высоких уровней витамина D на здоровье либо не поддерживалось достаточными доказательствами, чтобы установить причинно-следственную связь, либо имело противоречивый характер существующих на данный момент доказательств, которые не могут быть использованы для установления связи здоровья с конкретными уровнями потребления витамина D или определяемыми в сыворотке крови концентрациями 25(OH)D при любом уровне значимости.
Остеопороз
Более 40 млн взрослых в Соединенных Штатах подвержены риску развития остеопороза, заболевания, характеризующегося низкой костной массой и структурной дезорганизацией костной ткани, при котором повышается хрупкость костей и значительно увеличивается риск переломов [37]. Остеопороз чаще всего связан с недостаточным потреблением кальция, но недостаточность витамина D также способствует развитию заболевания, снижая всасывание кальция [38]. Несмотря на то, что рахит и остеомаляция представляют собой крайние примеры последствий дефицита витамина D, остеопороз является результатом долгосрочного влияния недостатка кальция и витамина D. Адекватные уровни витамина D поддерживают прочность костей и могут способствовать профилактике остеопороза у пожилых людей, у лиц, которые испытывают трудности в физической активности, у женщин в постменопаузе и лиц, получающих длительную терапию стероидными препаратами [39].
В нормальной кости постоянно происходят процессы ремоделирования. Во время менопаузы баланс между этими процессами костеобразования и костеразрушения изменяется, в результате чего больше костной ткани разрушается, чем восстанавливается. Гормональная терапия эстрогенами и эстроген/гестагенными препаратами могла бы задержать развитие остеопороза. Тем не менее, большинство медицинских групп и профессиональных сообществ, занимающихся вопросами менопаузы, рекомендуют рассмотреть возможность использования других средств для замедления или предотвращения резорбции костной ткани у женщин в постменопаузе из-за возможного неблагоприятного воздействия на здоровье заместительной гормональной терапии [40, 41, 42].
Большинство исследований, посвященных влиянию витамина D на здоровье костей, также включало препараты кальция, так что трудно выделить эффекты каждого питательного вещества в отдельности. Среди женщин в постменопаузе и мужчин старшего возраста добавки витамина D и кальция приводят к незначительному увеличению минеральной плотности костной ткани во всех отделах скелета. Они также помогают снизить частоту переломов среди пожилых пациентов, находящихся в домах престарелых, при этом данные о пользе приема препаратов кальция и витамина D у других групп пожилых людей противоречивы [1, 2, 43]. Метаанализ влияния приема витамина D показал защитное действие добавок витамина D от падений [44]. Несомненно, что оценка уровней витамина D и адекватное потребление витамина D должны входить в общий план профилактики и лечения остеопороза.
Рак
Данные, полученные на людях и животных, а также в эпидемиологических исследованиях, свидетельствуют о том, что витамин D может влиять на риск развития онкологических заболеваний. Сильная доказательная база существует по роли витамина D в предотвращении рака толстой кишки, простаты и молочной железы. Последние эпидемиологические данные свидетельствуют о том, что витамин D может оказывать защитное действие против рака толстой кишки, но более сильный защитный эффект он оказывает против рака простаты и молочной железы. Его влияние на риск рака других локализаций противоречив [1, 46, 47]. Исследования не показывают последовательного защитного действия или отсутствия влияния. Одно исследование среди финских курильщиков, например, обнаружило, что субъекты с уровнем базового статуса витамина D в высшем квантиле имели в три раза более высокий риск развития рака поджелудочной железы [48]. В недавнем обзоре был обнаружен повышенный риск развития рака поджелудочной железы, связанный с высокими уровнями сывороточного 25(OH)D (≥100 нмоль/л, или ≥40 нг/мл) [49].
Витамин D проявил себя как защитный фактор в проспективном перекрестном исследовании 3121 взрослых в возрасте ≥50 лет (96% пациентов были мужчины), которые подверглись колоноскопии. Исследование показало, что 10% из них имели, по крайней мере, одно распространенное онкологическое заболевание. У лиц с самым высоким уровнем потребления витамина D (>645 МЕ/сут) выявлен значительно более низкий риск этих поражений [50]. Тем не менее, в широко цитируемом исследовании Woman's Health Initiative, в которое были включены 36 282 женщин в постменопаузе, различных рас и этнических групп, рандомизированных для получения 400 МЕ витамина D плюс 1000 мг кальция в день или плацебо, не было обнаружено значимых различий между группами в частоте возникновения колоректального рака в течение 7 лет наблюдения [51]. В последнем клиническом исследовании, посвященном здоровью костей у 1179 женщин в постменопаузе, проживающих в сельской местности штата Небраска (США), обнаружено, что среди лиц, получавших ежедневно добавки кальция (1400–1500 мг) и витамина D3 (1100 МЕ), заболеваемость раком в течение 4 лет была значительно ниже по сравнению с женщинами, принимавших плацебо [52]. Небольшое количество раков (50), зарегистрированных в исследовании, не дает возможности распространить эти данные на всю популяцию. Это ограничение касается и анализа 16 618 участников в NHANES III (1988–1994), в котором общая смертность от рака оказалась связанной с базовым статусом витамина D [53]. Тем не менее, смертность от рака толстой кишки была обратно пропорционально связана с сывороточной концентрацией 25(OH)D. Большое наблюдательное исследование с участниками из 10 стран Западной Европы также обнаружило сильную обратную связь между исходными уровнями 25(OH)D и риском колоректального рака [54].
Необходимы дальнейшие исследования для прояснения вопросов, касающихся, в частности, того, повышает ли недостаточность витамина D риск развития рака, может ли увеличение потребления витамина D оказывать профилактическое действие и могут ли лица, получающие витамин D, подвергаться повышенному риску рака [46, 55]. В целом, исследования на сегодняшний день не поддерживают роль витамина D, с или без препаратов кальция, в снижении риска развития онкологических болезней [1].
Другие заболевания
Все больше исследований показывают, что витамин D может играть определенную роль в профилактике и лечении сахарного диабета 1 [56] и 2 типа [57], гипертензии [58], нарушения толерантности к глюкозе [59], рассеянного склероза [60] и других заболеваний [61, 62]. Однако большая часть доказательств этой роли витамина D получена в исследованиях in vitro, на животных моделях и в эпидемиологических исследованиях, а не в рандомизированных клинических испытаниях, которые признаны наиболее доказательными [1]. Пока такие испытания проводятся, влияние витамина D на здоровье населения и пациентов будет активно обсуждаться. В одном из мета-анализов было показано, что использование витамина D связано со статистически значимым снижением общей смертности от всех причин [63, 64], но повторный анализ данных не нашел такой ассоциации [43]. Систематический обзор этих и других последствий для здоровья, связанных с потреблением витамина D и кальция, как в отдельности, так и в комбинации, был опубликован в августе 2009 г. [43].
Риски для здоровья от чрезмерного приема витамина D
Токсичность витамина D может вызывать неспецифические симптомы, такие как анорексия, потеря веса, полиурия и возникновение сердечных аритмий. Витамин D также может повышать уровни кальция в крови, что приводит к кальцификации сосудов и мягких тканей, с последующим повреждением сердца, кровеносных сосудов и почек [1]. Использование добавок кальция (1000 мг/сут) и витамина D (400 МЕ) в постменопаузе было связано с 17% повышением риска образования камней в почках в течение 7 лет в исследовании Woman's Health Initiative [65]. Сывороточный уровень 25(OH)D>500 нмоль/л (> 200 нг/мл) считается потенциально токсичным [5].Чрезмерное пребывание на солнце не вызывает токсичности витамина D, так как при продолжительном нагреве кожи, по некоторым предположениям, происходит фотодеградация провитамина D3 и витамина D3 в момент их образования [6]. Кроме того, термическая активация провитамина D3 в коже приводит к образованию различных других секостероидов, которые ограничивают образование витамина D3. Некоторые изоформы витамина D3 также преобразуются в неактивные вещества [1]. Получение токсических доз витамина D с пищевыми продуктами очень маловероятно. Прием высоких доз витамина D в виде пищевых добавок с гораздо большей частотой может приводить к токсическим уровням витамина в крови.
Длительное потребление витамина D выше максимально допустимых уровней (UL) повышает риск неблагоприятных последствий для здоровья [1] (табл. 4).
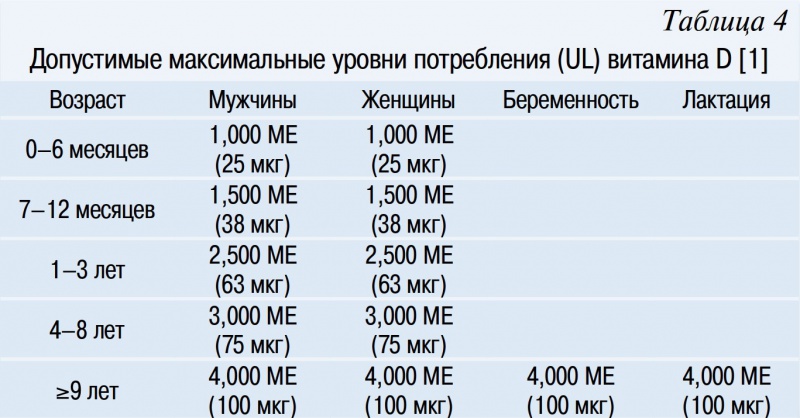
Большинством исследований порог токсичности витамина D устанавливается от 10 000 до 40 000 МЕ/сут, а сывороточные уровни 25(OH)D порядка 500–600 нмоль/л (200–240 нг/мл). Несмотря на то, что симптомы интоксикации маловероятны при дневном потреблении менее 10 000 МЕ/сут, имеются научные данные наблюдательных исследований и клинических испытаний, которые указывают, что даже меньшие дозы потребления витамина D и сывороточные уровни 25(OH)D крови могут иметь отрицательные последствия для здоровья с течением времени. Специалисты Комитета пищевых продуктов и питания США пришли к выводу, что следует избегать сывороточных уровней 25(OH)D более 125–150 нмоль/л (50–60 нг/мл), поскольку даже уровни ниже 75–120 нмоль/л или 30–48 нг/мл могут быть связаны с увеличением смертности от всех причин, более высоким риском некоторых онкологических заболеваний, таких как рак поджелудочной железы, более высоким риском сердечно-сосудистых заболеваний, а также увеличением частоты падений и переломов у пожилых людей. Комитет провел исследование, которое показало, что при приеме витамина D в дозе 5000 МЕ/сут достигаются сывороточные уровни 25(OH)D порядка 100–150 нмоль/л (40–60 нг/мл), но не выше. Применение фактора неопределенности 20% потребления витамина D дало значение UL, равное 4000 МЕ, которое отнесено к детям в возрасте от 9 лет и старше, с соответствующим меньшим количеством для детей младшего возраста.
Взаимодействие с лекарствами
Препараты витамина D могут потенциально взаимодействовать с несколькими типами лекарственных препаратов. Поэтому их прием необходимо учитывать при назначении препаратов витамина D.Кортикостероидные препараты, такие как преднизолон, часто назначают для уменьшения воспаления при аутоиммунных заболеваниях. Кортикостероиды могут уменьшить всасывание кальция [66, 67, 68] и нарушают метаболизм витамина D. Эти эффекты могут еще больше способствовать потере костной ткани и развитию остеопороза, связанных с длительным приемом кортикостероидных препаратов.
Препарат для снижения массы тела, орлистат (торговые названия Ксеникал и Орсотен), а также препарат для снижения холестерина крови, колестирамин (торговое название Квестран), могут уменьшать всасывание витамина D и других жирорастворимых витаминов [69, 70]. Препараты фенобарбитал и фенитоин, которые используются для профилактики и лечения эпилептических приступов, повышают метаболизм в печени витамина D в неактивные соединения и снижают всасывание кальция в кишечнике [71].
2. Cranney C, Horsely T, O'Donnell S, Weiler H, Ooi D, Atkinson S, et al. Effectiveness and safety of vitamin D. Evidence Report/Technology Assessment No. 158 prepared by the University of Ottawa Evidence-based Practice Center under Contract No. 290-02.0021. AHRQ Publication No. 07-E013. Rockville, MD: Agency for Healthcare Research and Quality, 2007.
3. Holick MF. Vitamin D. In: Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ, eds. Modern Nutrition in Health and Disease, 10th ed. Philadelphia: Lippincott Williams & Wilkins, 2006.
4. Norman AW, Henry HH. Vitamin D. In: Bowman BA, Russell RM, eds. Present Knowledge in Nutrition, 9th ed. Washington DC: ILSI Press, 2006.
5. Jones G. Pharmacokinetics of vitamin D toxicity. Am J Clin Nutr 2008;88:582S–6S.
6. Holick MF. Vitamin D deficiency. N Engl J Med 2007;357:266–81.
7. Carter GD. 25-hydroxyvitamin D assays: the quest for accuracy. Clin Chem 2009;55:1300–02.
8. Hollis BW. Editorial: the determination of circulating 25-hydroxyvitamin D: no easy task. J. Clin Endocrinol Metab 2004;89:3149–3151.
9. Binkley N, Krueger D, Cowgill CS, Plum L, Lake E, Hansen KE, et al. Assay variation confounds the diagnosis of hypovitaminosis D: a call for standardization. J Clin Endocrinol Metab 2004;89:3152–57.
10. National Institute of Standards and Technology. NIST releases vitamin D standard reference material, 2009; www.nist.gov/public_affairs/techbeat/ tb2009_0714.htm; доступно на 28.03.2012.
11. U.S. Department of Agriculture, Agricultural Research Service. 2011. USDA National Nutrient Database for Standard Reference, Release 24. Nutrient Data Laboratory Home Page; www.ars.usda.gov/ba/bhnrc/ndl, доступно на
27.03.2012.
12. Ovesen L, Brot C, Jakobsen J. Food contents and biological activity of 25-hydroxyvitamin D: a vitamin D metabolite to be reckoned with? Ann Nutr Metab 2003;47:107–13.
13. Mattila PH, Piironen VI, Uusi-Rauva EJ, Koivistoinen PE. Vitamin D contents in edible mushrooms. J Agric Food Chem 1994;42:2449–53.
14. Calvo MS, Whiting SJ, Barton CN. Vitamin D fortification in the United States and Canada: current status and data needs. Am J Clin Nutr 2004;80:1710S–6S.
15. Byrdwell WC, DeVries J, Exler J, Harnly JM, Holden JM, Holick MF, et al. Analyzing vitamin D in foods and supplements: methodologic challenges. Am J Clin Nutr 2008;88:554S–7S.
16. Wharton B, Bishop N. Rickets. Lancet 2003;362:1389–400.
17. Holick MF. Photobiology of vitamin D. In: Feldman D, Pike JW, Glorieux FH, eds. Vitamin D, Second Edition, Volume I. Burlington, MA: Elsevier, 2005.
18. Wolpowitz D, Gilchrest BA. The vitamin D questions: how much do you need and how should you get it? J Am Acad Dermatol 2006;54:301–17.
19. Holick MF. Vitamin D: the underappreciated D-lightful hormone that is important for skeletal and cellular health. Curr Opin Endocrinol Diabetes 2002;9:87–98.
20. International Agency for Research on Cancer Working Group on ultraviolet (UV) light and skin cancer. The association of use of sunbeds with cutaneous malignant melanoma and other skin cancers: a systematic review. Int J Cancer 2006;120:1116–22.
21. American Academy of Dermatology. Position statement on vitamin D. November 1, 2008; www.aad.org/Forms/Policies/Uploads/PS/PS-Vitamin%20D.pdf, доступно на 28.03.2012.
22. Wagner CL, Greer FR; American Academy of Pediatrics Section on Breastfeeding; American Academy of Pediatrics Committee on Nutrition. Prevention of rickets and vitamin D deficiency in infants, children, and adolescents,Pediatrics 2008;122:1142–1152.
23. Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM, Hanley DA, Heaney RP, Murad MH, Weaver CM; Endocrine Society. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2011 Jul;96(7):1911–30.
24. Looker AC, Pfeiffer CM, Lacher DA, Schleicher RL, Picciano MF, Yetley EA. Serum 25-hydroxyvitamin D status of the US population: 1988–1994 compared with 2000–2004. Am J Clin Nutr 2008;88:1519–27.
25. Chesney R. Rickets: an old form for a new century. Pediatr Int 2003;45:509–11.
26. Goldring SR, Krane S, Avioli LV. Disorders of calcification: osteomalacia and rickets. In: DeGroot LJ, Besser M, Burger HG, Jameson JL, Loriaux DL, Marshall JC, et al., eds. Endocrinology. 3rd ed. Philadelphia: WB Saunders, 1995:1204–27.
27. Picciano MF. Nutrient composition of human milk. Pediatr Clin North Am 2001;48:53–67.
28. Weisberg P, Scanlon KS, Li R, Cogswell ME. Nutritional rickets among children in the United States: review of cases reported between 1986 and 2003. Am J Clin Nutr 2004;80:1697S–705S.
29. Ward LM, Gaboury I, Ladhani M, Zlotkin S. Vitamin D-deficiency rickets among children in Canada. CMAJ 2007;177:161–166.
30. American Academy of Pediatrics Committee on Environmental Health. Ultraviolet light: a hazard to children. Pediatrics 1999;104:328–33.
31. Webb AR, Kline L, Holick MF. Influence of season and latitude on the cutaneous synthesis of vitamin D3: Exposure to winter sunlight in Boston and Edmonton will not promote vitamin D3 synthesis in human skin. J Clin Endocrinol Metab 1988;67:373–8.
32. Webb AR, Pilbeam C, Hanafin N, Holick MF. An evaluation of the relative contributions of exposure to sunlight and of diet to the circulating concentrations of 25-hydroxyvitamin D in an elderly nursing home population in Boston. Am J Clin Nutr 1990;51:1075–81.
33. Lo CW, Paris PW, Clemens TL, Nolan J, Holick MF. Vitamin D absorption in healthy subjects and in patients with intestinal malabsorption syndromes. Am J Clin Nutr 1985;42:644–49.
34. Malone M. Recommended nutritional supplements for bariatric surgery patients. Ann Pharmacother 2008;42:1851–8.
35. Compher CW, Badellino KO, Boullata JI. Vitamin D and the bariatric surgical patient: a review. Obes Surg 2008;18:220–4.
36. Vieth R, Bischoff-Ferrari H, Boucher BJ, Dawson-Hughes B, Garland CF, Heaney RP, et al. The urgent need to recommend an intake of vitamin D that is effective. Am J Clin Nutr 2007;85:649–50.
37. National Institutes of Health Osteoporosis and Related Bone Diseases National Research Center.Osteoporosis overview. October 2010; www. niams.nih.gov/Health_Info/Bone/Osteoporosis/overview.asp, доступно на
27.03.2012.
38. Heaney RP. Long-latency deficiency disease: insights from calcium and vitamin D. Am J Clin Nutr 2003;78:912–9.
39. LeBoff MS, Kohlmeier L, Hurwitz S, Franklin J, Wright J, Glowacki J. Occult vitamin D deficiency in postmenopausal US women with acute hip fracture. JAMA 1999;251:1505–11.
40. Kirschstein R. Menopausal hormone therapy: summary of a scientific workshop. Ann Intern Med 2003;138:361–4.
41. American College of Obstetricians and Gynecologists. Frequently Asked Questions About Hormone Therapy. New Recommendations Based on ACOG's Task Force Report on Hormone Therapy, 2004; www.acog.org/Resources_And_ Publications/Task_Force_and_Work_Group_Reports_List; доступно на 28.03.2012.
42. North American Menopause Society. Role of progestrogen in hormone therapy for postmenopausal women: position statement of The North American Menopause Society. Menopause 2003;10:113–32.
43. Chung M, Balk EM, Brendel M, Ip S, Lau J, Lee J, et al. Vitamin D and calcium: a systematic review of health outcomes, 2009; www.ahrq.gov/clinic/tp/vitadcaltp.htm#Report, доступно на 28.03.2012.
44. Bischoff-Ferrari HA, Dawson-Hughes B, Staehelin HB, Orav JE, Stuck AE, Theiler R, et al. Fall prevention with supplemental and active forms of vitamin D: a meta-analysis of randomised controlled trials. BMJ 2009;339:b3692.
45. Ensrud KE, Ewing SK, Fredman L, Hochberg MC,Cauley JA, Hillier TA, et al. Circulating 25-hydroxyvitamin D levels and frailty status in older women. J ClinEndocrinolMetab 2010;95:5266–5273.
46. Davis CD. Vitamin D and cancer: current dilemmas and future research needs. Am J Clin Nutr 2008;88:565S–9S.
47. Davis CD, Hartmuller V, Freedman M, Hartge P, Picciano MF, Swanson CA, Milner JA. Vitamin D and cancer: current dilemmas and future needs. Nutr Rev 2007;65:S71–S74.
48. Stolzenberg-Solomon RZ, Vieth R, Azad A, Pietinen P, Taylor PR, Virtamo J, et al. A prospective nested case-control study of vitamin D status and pancreatic cancer risk in male smokers. Cancer Res 2006;66:10213–9.
49. Kathy J. Helzlsouer for the VDPP Steering Committee. Overview of the Cohort Consortium Vitamin D Pooling Project of Rarer Cancers. Am J Epidemiol 2010;172:4–9.
50. Lieberman DA, Prindiville S, Weiss DG, Willett W. Risk factors for advanced colonic neoplasia and hyperplastic polyps in asymptomatic individuals. JAMA 2003;290:2959–67.
51. Wactawski-Wende J, Kotchen JM, Anderson GL, Assaf AR, Brunner RL, O'Sullivan MJ, et al. Calcium plus vitamin D supplementation and the risk of colorectal cancer. N Engl J Med 2006;354:684–96.
52. National Institutes of Health. Office of Dietary Supplements. Dietary spplement fact sheet: Vitamin D (версия от 24.06.2011); ods.od.nih.gov/factsheets/ VitaminD-HealthProfessional/, доступно от 28.03.2012.
53. Freedman DM, Looker AC, Chang S-C, Graubard BI. Prospective study of serum vitamin D and cancer mortality in the United States. J Natl Cancer Inst 2007;99:1594–602.
54. Jenab M, Bueno-de-Mesquita HB, Ferrari P, van Duijnhoven FJB, Norat T, Pischon T, et al. Association between pre-diagnostic circulating vitamin D concentration and risk of colorectal cancer in European populations: a nested case-control study. BMJ 2010;340:b5500.
55. Davis CD, Dwyer JT. The 'sunshine vitamin': benefits beyond bone? J Natl Cancer Inst 2007;99:1563–5.
56. Hyppönen E, Läärä E, Reunanen A, Järvelin MR, Virtanen SM. Intake of vitamin D and risk of type 1 diabetes: a birth-cohort study. Lancet 2001;358:1500–3.
57. Pittas AG, Dawson-Hughes B, Li T, Van Dam RM, Willett WC, Manson JE, et al. Vitamin D and calcium intake in relation to type 2 diabetes in women. Diabetes Care 2006;29:650–6.
58. Krause R, Bühring M, Hopfenmüller W, Holick MF, Sharma AM. Ultraviolet B and blood pressure. Lancet 1998;352:709–10.
59. Chiu KC, Chu A, Go VL, Saad MF. Hypovitaminosis D is associated with insulin resistance and beta cell dysfunction. Am J Clin Nutr 2004;79:820–5.
60. Munger KL, Levin LI, Hollis BW, Howard NS, Ascherio A. Serum 25-hydroxyvitamin D levels and risk of multiple sclerosis. JAMA 2006;296:2832–8.
61. Merlino LA, Curtis J, Mikuls TR, Cerhan JR, Criswell LA, Saag K. Vitamin D intake is inversely associated with rheumatoid arthritis: results from the Iowa Women's Health Study. Arthritis Rheum 2004;50:72–7.
62. Schleithoff SS, Zittermann A, Tenderich G, Berthold HK, Stehle P, Koerfer R. Vitamin D supplementation improves cytokine profiles in patients with congestive heart failure: a double blind, randomized, placebo-controlled trial. Am J Clin Nutr 2006;83:754–9.
63. Autier P, Gandini S. Vitamin D supplementation and total mortality: a meta-analysis of randomized controlled trials. Arch Intern Med 2007;167:1730–7.
64. Giovannucci E. Can vitamin D reduce total mortality? Arch Intern Med 2007;167:1709–10.
65. Jackson RD, LaCroix AZ, Gass M, Wallace RB, Robbins J, Lewis CE, et al. Calcium plus vitamin D supplementation and the risk of fractures. N Engl J Med 2006;354:669–83.
66. Buckley LM, Leib ES, Cartularo KS, Vacek PM, Cooper SM. Calcium and vitamin D3 supplementation prevents bone loss in the spine secondary to low-dose corticosteroids in patients with rheumatoid arthritis. A randomized, double-blind, placebo-controlled trial. Ann Intern Med 1996;125:961–8.
67. Lukert BP, Raisz LG. Glucocorticoid-induced osteoporosis: pathogenesis and management. Ann Intern Med 1990;112:352–64.
68. de Sevaux RGL, Hoitsma AJ, Corstens FHM, Wetzels JFM. Treatment with vitamin D and calcium reduces bone loss after renal transplantation: a randomized study. J Am Soc Nephrol 2002;13:1608–14.
69. McDuffie JR, Calis KA, Booth SL, Uwaifo GI, Yanovski JA. Effects of orlistat on fat-soluble vitamins in obese adolescents. Pharmacotherapy 2002;22:814–22.
70. Compston JE, Horton LW. Oral 25-hydroxyvitamin D3 in treatment of osteomalacia associated with ileal resection and cholestyramine therapy. Gastroenterology 1978;74:900–2.
71. Gough H, Goggin T, Bissessar A, Baker M, Crowley M, Callaghan N. A comparative study of the relative influence of different anticonvulsant drugs, UV exposure and diet on vitamin D and calcium metabolism in outpatients with epilepsy. Q J Med 1986;59:569–77.
Авторы:
Плещева А.В.
аспирант отделения нейроэндокринологии и остеопатии, ФГБУ «Эндокринологический научный центр» Минздравсоцразвития России
E-mail: nastia040883@mail.ru
Пигарова Е.А.
к.м.н., ст.н.с. отделения нейроэндокринологии и остеопатии, ФГБУ «Эндокринологический научный центр» Минздравсоцразвития России
E-mail: kpigarova@gmail.com
Дзеранова Л.К.
д.м.н., гл.н.с. отделения нейроэндокринологии и остеопатии, ФГБУ «Эндокринологический научный центр» Минздравсоцразвития России
E-mail: metabol@endocrincentr.ru
ФГБУ «Эндокринологический научный центр» Минздравсоцразвития России (директор – академик РАН и РАМН И.И. Дедов)
Комментарии - 0