Трансплантация фекальной микробиоты продлила жизнь преждевременно стареющим мышам
Bárcena et al. / Nature Medicine, 2019
Трансплантация фекальной микробиоты и пероральное назначение бактерий Akkermansia muciniphila продлили жизнь мышам с прогерией (преждевременным старением) и улучшили показатели их здоровья. К таким вмешательствам ученые прибегли после изучения кишечной микрофлоры мышей и людей с прогерией и ее сравнения с микрофлорой долгожителей. Статья опубликована в Nature Medicine.
В настоящее время известен ряд эффектов кишечной микробиоты на здоровье . Так, у млекопитающих она влияет на чувство насыщения, может защищать от патогенов, участвует в пищеварении и синтезе витаминов, вторичных желчных и короткоцепочечных жирных кислот. Известна ее связь с ожирением, сахарным диабетом 2 типа, сердечно-сосудистыми заболеваниями, неалкогольной жировой болезнью печени, раком и ответом на противораковую терапию.
Ранее ученые исследовали профиль кишечной микробиоты у долгожителей, но ее изменения при синдромах преждевременного старения и влияние на такие состояния описаны не были. Прогерией называют очень редкие генетические расстройства, которые проявляются признаками старения в очень раннем возрасте. Наиболее изученный синдром прогерии Хатчинсона-Гилфорда (СПХГ) наследуется по аутосомно-доминантному типу.
Клеа Барсена (Clea Bárcena) из Университета Овьедо в Испании и ее коллеги задались целью узнать, существуют ли в кишечнике специфические дисбиозы, которые можно связать с прогероидными синдромами, и какой эффект на мышей с прогерией могут оказывать изменения в их микробиоме.
Сначала ученые решили разобраться, насколько актуальным показателем является профиль кишечной микробиоты при прогерии, можно ли выделить его характерные черты. Для этого они провели исследования на мышах и на людях. Они сравнили метагеномы бактерий, живущих в кишечнике мышей линии LmnaG609G/G609G (модель СПХГ) и мышей дикого типа. На первом месяце жизни данные обеих групп мышей были сходными, но с четвертого обнаруживались заметные различия. Например, у быстро стареющих мышей уменьшалось количество бактерий родов Akkermansia и Dehalobacterium на фоне увеличения количества протеобактерий и цианобактерий. Аналогичные результаты ученые получили, повторив исследование на мышах Zmpste24−/− (другой модели СПХГ).
Далее авторы проверили, обнаруживается ли специфический дисбиоз в кишечнике у пациентов с прогерией. Они изучили кал четырех детей с СПХГ и их здоровых братьев и сестер, также изучили фекальный микробиом ребенка с синдромом Нестора-Гильермо и его семьи. Несмотря на небольшое количество образцов, результаты говорили в пользу того, что окружающая среда оказывает на микробиом кишечника большее влияние, чем прогерия. Дальнейший анализ показал уменьшение количества бактерий рода Gemmige и увеличение количества ряда клостридий. Ученые заключили, что дисбиоз усугубляется со временем как у мышей, так и у людей с прогерией.
Ученые предположили, что люди с исключительной продолжительностью жизни могут быть носителями микробиома, который может улучшать здоровье других. Их находки согласуются с предыдущими исследованиями: у долгожителей они обнаружили большие количества бактерий Akkermansia и Christensenellaceae и низкий уровень протеобактерий по сравнению с контролем.
Далее ученые установили, будут ли дольше жить мыши с прогерией, если им изменить микробиом. В этой части работы мышей Lmna-G609G разделили на четыре группы по 11 особей. Мышам из группы лечения провели трансплантацию фекальной микробиоты (ТФМ) от здоровых мышей дикого типа. В контрольной группе были животные, не подвергавшиеся каким-либо вмешательствам. Мыши третьей группы получили ТФМ от более старых мышей LmnaG609G/G609G, а в четвертой группе была проведена симуляция трансплантации микробиоты.
Больные мыши, получившие бактерий от здоровых, демонстрировали улучшение состояния, прогерия замедлялась. Это проявлялось замедлением потери веса, нормализацией уровня глюкозы в крови, а также смягчением некоторых других симптомов. Главное, мыши из группы лечения жили в среднем на 13,5 процентов дольше контроля (160 дней против 141 дня).
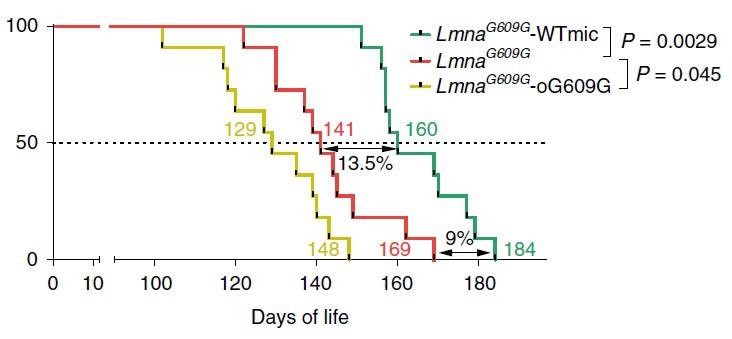
Процент выживания мышей LmnaG609G/G609G (красный график), мышей Lmna-G609G после ТФМ от мышей дикого типа (зеленый график) и мышей Lmna-G609G после ТФМ от старых особей Lmna-G609G.
Bárcena et al. / Nature Medicine, 2019
В третьей группе тансплантация не привела к ускорению старения, но у мышей наблюдались нарушения обмена веществ: они тратили меньше энергии и набирали вес, у них был выше уровень глюкозы в крови. Сходные результаты были получены и на мышах Zmpste24−/−.
Изучение кишечного метагенома как у мышей, так и у людей показало уменьшение количества A. muciniphila при синдроме преждевременного старения. Кроме того, ранее в экспериментах на животных использование этой бактерии положительно влияло на обмен веществ и улучшало ответ на иммунотерапию. Поэтому ученые сочли целесообразным проверить, может ли назначение A. muciniphila улучшить здоровье мышей Lmna-G609G и продлить им жизнь. Увеличение продолжительности жизни по сравнению с контролем в этом случае оказалось несколько меньшим, чем при ТФМ, в среднем не более 10 дней. По мнению ученых, это свидетельствует о защитной роли микроорганизма при ускоренном старении. Они объясняют это воздействие усилением экспрессии гена Reg3g, утолщением слизистой оболочки кишечника и улучшением ее заживления.
Чтобы уточнить другие возможные механизмы, которые стоят за улучшением здоровья мышей и увеличением продолжительности их жизни после ТФМ, ученые провели профилирование метаболома кишечной микробиоты мышей дикого типа, мышей Lmna-G609G и мышей Lmna-G609G, получивших трансплантат. После анализа различий авторы предположили, что положительную роль может играть усиление синтеза вторичных желчных кислот.
Хейди Запата (Heidi Zapata) из Йельского университета, которая изучала микробиом людей при старении и возрастных патологиях, назвала исследование интересным, но предостерегла от преждевременного проецирования его результатов на людей. «Я не думаю, что мы близки к обретению таблетки, которую могли бы глотать мы. Но учитывая важность микробиома, это предзнаменует будущие возможности», — сказала она.
Ранее в небольшом исследовании ученые показали, что пероральный прием A. muciniphila людьми может снижать риск болезней сердца и сахарного диабета при метаболическом синдроме. Также ученые описали изменения микробиома при фибромиалгии и продемонстрировали облегчение симптомов аутизма у небольшой группы детей, получивших ТФМ.
Автор: Андрей Украинский
Источник: N+1
Комментарии - 0